Vernetzung von elektrogesponnenen Chitosan-Nanofasern mit Genipin für medizinische Anwendungen und Tissue Engineering
Zusammenfassung
In dieser Studie haben wir ein Verfahren zur Herstellung von Chitosan-Nanofaservliesen vorgestellt. Außerdem wurde gezeigt, dass Genipin eine vielversprechende Alternative für das zytotoxische Glutaraldehyd zur Vernetzung von Chitosan ist. Obwohl die Filtration einen großen Einfluss auf die Viskosität der Lösung hat, gibt es keinen signifikanten Einfluss auf den Faserdurchmesser, aber auf die Struktur der Nanofasern in der Ausprägung von Kräuselung im Vergleich zu glatten Fasern. Der Einfluss dieser gekräuselten Fasern (nach der Filtration) auf die Zellproliferation und das Zellverhalten muss in zukünftigen Studien untersucht werden.
Die Waschversuche zeigen die Fähigkeit von Genipin, Chitosan erfolgreich zu vernetzen. Die Auswirkung der Quellung auf die mechanischen Eigenschaften der Membran muss für die weitere Verwendung ebenfalls noch untersucht werden. Schließlich wird die Leistung dieser vernetzten Nanofaservliese in In-vitro-Zelllebensfähigkeitstests und Proliferationstests in weiteren Studien geprüft.
Bericht
Abstract
In dieser Studie wird Genipin zur Vernetzung von Nanofasern verwendet, die aus einer Lösung von Chitosan und Polyethylenoxid (PEO) (Verhältnis 7:3) in 70 %-iger Essigsäure elektrogesponnen wurden. Genipin ist eine chemische Verbindung, die aus den Früchten der gardenis jasminoides ellis isoliert wird und mit freien Aminogruppen reagiert. Außerdem ist es 5.000 bis 10.000 Mal weniger zytotoxisch als Glutaraldehyd, der bisher am häufigsten verwendete Vernetzer für Chitosan. [SHH+99] Untersucht werden die Fasermorphologie, die mechanische Festigkeit, das Ergebnis der Fourier-Transformations-Infrarotspektroskopie (FTIR) und die Löslichkeit in einer wässrigen Lösung mittels gravimetrischer Messungen.
Es wurden erfolgreich Nanofasern hergestellt und dann teilweise mit Genipin vernetzt und die Vernetzung war erfolgreich. Ohne Vernetzung lösten sich die Fasern in wässriger Lösung auf, während vernetzte Fasern stabil gequollen sind. Nicht vernetzte Fasern haben einen Faserdurchmesser von 573 ± 81 nm, vernetzte 560 ± 96 nm. Nach dem Quellen betragen die Faserdurchmesser 901 ± 105 nm.
1. Einleitung
Mit einer hohen spezifischen Oberfläche, einer hohen Porosität und einer ähnlichen Größe wie die extrazelluläre Matrix (ECM) im menschlichen Körper haben elektrogesponnene Nanofasern vorteilhafte Eigenschaften für medizinische Anwendungen und Tissue Engineering [KC17]. Chitosan ist ein natürliches Biopolymer mit guter Biokompatibilität und biologischer Abbaubarkeit und weist ebenfalls Ähnlichkeiten mit der ECM auf. Nanofasern aus Chitosan wurden in der Vergangenheit bereits elektrogesponnen, welche in wässrigen Lösungen schlechte Eigenschaften (mechanische Festigkeit, Anfälligkeit für enzymatischen Abbau, Auflösen) zeigen. Die Vernetzung führt zur Kopplung von funktionellen Gruppen im Chitosan und damit zu einer Stabilisierung des Polymers, wodurch die oben genannten Einschränkungen in wässrigen Lösungen verringert werden. Der am häufigsten verwendete Vernetzer für Chitosan ist Glutaraldehyd, der eine sehr hohe Zytotoxizität aufweist und brüchige und schwächere Fasern erzeugt. [SHH+99] Ein weniger zytotoxischer Vernetzer ist Genipin, das bereits zur Vernetzung von Kollagen und Gelatine für medizinische Anwendungen verwendet wird. Genipin reagiert mit den freien Aminogruppen des Chitosans und erhöht die Stabilität in flüssigen Medien. [MFS+14]
Chitosan als natürliches Polymer unterliegt Schwankungen in der Materialqualität und im Molekulargewicht. Lösungen von Chitosan enthalten unlösliche Teile und Partikel, die einen Einfluss auf den Spinnprozess oder die gesponnene Nanofaser haben können. Daher wird in der vorliegenden Arbeit die Lösung filtriert und der Einfluss des Filtrationsprozesses auf den Spinnprozess, die Fasermorphologie und die mechanischen Eigenschaften bewertet. Außerdem wird der Einfluss von Genipin auf die Fasermorphologie und den Vernetzungserfolg untersucht.
2. Materialien und Methoden
Die Chitosan/PEO-Nanofasermembranen werden im Elektrospinnverfahren mit einer Anlage vom Typ Fluidnatek LE500 (Bioinicia SL, Valencia, Spanien) hergestellt. Für das Elektrospinnen und die Herstellung der Nanofasermembranen werden Chitosan (Molekulargewicht 100 - 300 kDa, Acros Organics, Geel, Belgien), Polyethylenoxid (900 kDa, Sigma-Aldrich Chemie GmbH, Taufkirchen, Deutschland), Essigsäure (99,9 %), phosphatgepufferte Salzlösung (PBS), Ethanol (≥ 99,8 %, vergällt, alle Carl Roth GmbH + Co. KG, Karlsruhe, Deutschland) und Genipin (Enzo Life Sciences GmbH, Lörrach, Deutschland) verwendet. Alle Chemikalien werden wie geliefert und ohne weitere Aufreinigung verwendet.
Die Fasern werden aus einer Lösung mit einer Massenkonzentration von 1,2 Gew.-% Chitosan und 2,8 Gew.-% PEO in 70 %-iger Essigsäure gesponnen. Chitosan und PEO werden getrennt voneinander unter ständigem Rühren 12 Stunden lang in dem genannten Lösungsmittel gelöst. Die Lösungen werden im genannten Verhältnis gemischt und 2 Stunden lang unter ständigem Rühren homogenisiert. Zur Vernetzung von Chitosan nach dem Spinnprozess wird der Lösung vor dem Spinnen Genipin zugesetzt. Es wird ein Verhältnis von Chitosan zu Genipin von 100:1 verwendet, und das Genipin wird separat in Ethanol unter ständigem Rühren 2 Stunden lang gelöst und dann zur Chitosan/PEO-Lösung hinzugefügt. Zur Filtration der Lösung werden Einwegspritzenfilter (Chromafil Xtra GF/ PTFE-45/25, Macherey-Nagel, Düren, Deutschland) verwendet.
Zur Vorbereitung des Spinnvorgangs wird die Spinnlösung in eine 5 mL Spritze (B. Braun Melsungen AG, Melsungen, Deutschland) gefüllt, die an eine einzelne Spinndüse angeschlossen ist. Die Polymerlösung wird mittels Spritzenpumpe mit einer Flussrate von 1 mL/h durch eine Hohlnadel mit einem Durchmesser von 0,4 mm (B. Braun Melsungen AG, Melsungen, Deutschland) extrudiert. Bei einer Spannung von +20 kV und -1 kV wird die Polymerlösung zu Fasern verstreckt und auf einer rotierenden Welle (Ø = 30 mm, Breite = 300 mm) mit einer Rotationsgeschwindigkeit von 100 U/min gesammelt. Der Spinnprozess wird bei 23 °C und einer Luftfeuchtigkeit von 30 % r.F. durchgeführt.
Das Waschverfahren zur Untersuchung der Löslichkeit in einer wässrigen Lösung besteht aus drei Schritten. Es werden jeweils 4 Proben von mit Genipin vernetzten und nicht vernetzten Vliesstoffen mit einer Größe von 20 mm x 20 mm verwendet. Die Proben werden vor und nach jedem Schritt gewogen. Zunächst werden die Proben 20 Minuten lang in Ethanol gewaschen. Dann werden sie in einem Vakuumtrockenschrank (VT 6025, Thermo Scientific TM, Waltham, Deutschland) 24 Stunden lang bei 40 °C getrocknet. Anschließend werden die Proben separat in 15 ml PBS-Lösung (9,55 g PBS/l dest. Wasser) für 24 h eingelegt und anschließend bei Raumtemperatur für 72 h getrocknet.
2.1 Viskosimetrie
Die Polymerlösungen, die im Elektrospinnverfahren verwendet werden sollen, werden auf ihre Viskosität hin untersucht. Im Allgemeinen verhalten sich Polymerlösungen als nicht-newtonsche Flüssigkeiten, d.h. die Viskosität ist abhängig von der Scherrate, bei der sie gemessen wird. Die Messungen der Viskosität werden mit einem RheolabQC (CC27, Anton Paar, Graz, Österreich) durchgeführt. Die Viskosität (mPa∙s) wird bei Scherraten zwischen 50 und 1500 1/s an 200 Einzelpunkten im Abstand von 1,2 Sekunden gemessen. Anschließend werden die Ergebnisse in einem Diagramm aufgetragen, das den Trend der Viskosität in Abhängigkeit von der Scherrate darstellt.
2.2 Lichtmikroskopie
Die Durchmesser der Nanofasern werden mit dem Lichtmikroskop gemessen (Software: Leica Application Suite, Version 3.8.0, Mikroskop: DM4000 M, Leica, Wetzlar, Deutschland).
2.3 Fourier-Transformations-Infrarot-Spektroskopie
Das Vorhandensein von Chitosan nach dem Elektrospinnen und Waschen der Proben wird mit einem Nicolet iS 10 FTIR-Spektrometer und der Software OMNIC Specta (beide Thermo Scientific TM, Waltham, Deutschland) untersucht. Der Transmissionsmodus wurde im Bereich von 600 bis 4000 cm-1 verwendet.
2.4 Statistische Analyse
Die Daten von mindestens drei Exemplaren werden als Mittelwert und Standardabweichung angegeben. Jeder Versuch wurde zwei- oder dreimal wiederholt. Die statistische Analyse erfolgte durch einen Zwei-Wege-ANOVA-Test mit SPSS für Windows Version 11.5. Ein p < 0,05 wird als statistisch signifikant angesehen.
3. Ergebnisse
Lösungs- und Scaffold-Eigenschaften
Vier verschiedene Vliese wurden durch Elektrospinnen hergestellt. Die Konzentrationen und Verhältnisse der Polymerlösungen und der geeigneten Lösungsmittel sind das Ergebnis vorangegangener Experimente mit faktoriellem Design. Konzentrationen von Essigsäure zwischen 5 und 90 %, Gesamtpolymerkonzentrationen von 2, 3 und 4 Gew.-% und Polymerverhältnisse von Chitosan zu PEO von 7:3, 1:1 und 3:7 wurden hinsichtlich Löslichkeit und Verarbeitbarkeit bewertet. Experimente mit niedrigen Polymerkonzentrationen oder höheren Chitosankonzentrationen führten zu einem nicht stabilen Spinnprozess oder zum Versprühen der Lösung. Im Hinblick auf die Prozessstabilität und die resultierende Fasermorphologie zeigten Polymerlösungen mit 4 Gew.-% und einem Chitosan/PEO-Verhältnis von 3:7 in 70 %-iger Essigsäure die besten Ergebnisse und wurden daher für diese Studie ausgewählt.
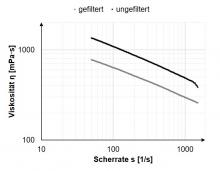
Abbildung 1: Viskosität von Chitosan/PEO-Lösungen mit einer Polymerkonzentration von 4 Gew.-% und einem Verhältnis von 7:3 im filtrierten (grau) und ungefilterten (schwarz) Zustand. Nach der Filtration sinkt die Viskosität aufgrund des Ausschlusses von Teilchen mit höherem Molekulargewicht.
Die Viskosität der endgültigen Lösung unterschied sich deutlich zwischen dem gefilterten und dem ungefilterten Zustand. Bei der ungefilterten Lösung ist die Viskosität im Bereich zwischen einer Scherrate von 50 und 1500 1/s deutlich höher (siehe Abbildung 1). Bei einer Scherrate von 100 1/s hat die ungefilterte Lösung eine Viskosität von 1087 ± 13 mPas und die gefilterte Lösung 635 ± 23 mPas. Bei 1500 1/s sinken die Werte auf 385 ± 34 mPas bzw. 285 ± 5 mPas.
Die Faserdurchmesser der aus ungefilterten Lösungen hergestellten Nanofasern betragen 573 ± 81 nm und die der Nanofasern aus gefilterten Lösungen 441 ± 132 nm. Der Unterschied zwischen den beiden Gruppen ist nicht signifikant, zeigt aber einen Trend. Abbildung 2 zeigt einen Unterschied in der Faserstruktur. Fasern aus ungefilterten Lösungen zeigen gerade Fasern, während Fasern aus ungefilterten Lösungen gekräuselte Merkmale aufweisen.
Abbildung 2: Lichtmikroskopische Aufnahmen von elektrogesponnenen Chitosan/PEO-Nanofasern aus ungefilterter (links) und gefilterter (rechts) Lösung.
FTIR wurde verwendet, um das Vorhandensein von Chitosan in den Nanofaservliesen nach dem Elektrospinnen und Veränderungen in der Struktur nach dem Filtrationsprozess zu zeigen. In Abbildung 3 zeigt die Kurve des Chitosanpulvers (gepunktet) charakteristische Banden von Chitosan in einem Wellenzahlbereich von 3100 bis 3400 cm-1. Diese sind auf N-H- und O-H-Streckschwingungen und intermolekulare Wasserstoffbrückenbindungen der Polysaccharidmoleküle zurückzuführen. Die Peaks bei 1583 und 1649 cm-1 zeigen NH2 (Amid II) bzw. C=O-NHR (Amid I) an. Der Peak im Wellenlängenbereich von 2800 bis 3000 cm-1 wird der CH2-Streckung zugeordnet. [CMH+08; RVM+11]
Die Kurven „ungefiltert“ und „gefiltert“ zeigen die Messungen der elektrogesponnenen Proben. Die Kurvenformen der gefilterten und ungefilterten Proben zeigen keine signifikanten Unterschiede in den Peaks. Demnach hat die Filtration der Chitosanlösung keinen Einfluss auf die chemischen Strukturen. Die charakteristischen Peaks von Chitosan sind in den Kurven der elektrogesponnenen Proben zu finden. Die Intensität der CH2-Streckung bei 2861 cm-1 nimmt mit dem Zusatz von PEO zu. In ähnlicher Weise werden Peakverschiebungen im Vergleich zu Chitosan beobachtet. Die Schwingungsbanden bei 1583, 1649 und 3348 cm-1 sind zu 1562, 1663 und 3353 cm-1 verschoben. Diese Peakverschiebungen sind auf die Abnahme der intermolekularen Wasserstoffbrückenbindungen von Chitosan und die Bildung neuer Wasserstoffbrückenbindungen zwischen Chitosan und PEO-Molekülen zurückzuführen [CMH+08]. Die FTIR-Ergebnisse zeigen, dass Chitosan in den elektrogesponnenen Vliesen vorhanden ist und dass es während der Filtration nicht entfernt oder beschädigt wird.
Abbildung 3: FTIR-Ergebnisse für das reine Chitosan-Pulver und Chitosan/PEO-Nanofaservliese aus gefilterten und ungefilterten Spinnlösungen. Alle Kurven zeigen typische Peaks für Chitosan zwischen 3100 und 3400 cm-1. Leichte Verschiebung der Kurven für Fasern aufgrund des Einflusses von PEO auf Wasserstoffbrückenbindungen.
Löslichkeit in wässriger Lösung
Membranen ohne Genipin wurden während des Waschvorgangs vollständig aufgelöst. Sie konnten daher nicht weiter untersucht werden. Mit Genipin vernetzte Proben weisen nach dem Waschvorgang eine Farbänderung auf. Die Farbe ändert sich von einem hellen Weiß zu einem grün-blauen Farbton, wie in Abbildung 4 zu sehen ist. Dies ist auf die Chitosanderivate zurückzuführen, die durch die Reaktion von Genipin mit den Aminogruppen von Chitosan gebildet werden [MSS00].
Abbildung 4: A) Chitosan/PEO-Nanofaser-Vliesstoff mit eingearbeitetem Genipin vor dem Waschvorgang, hellweiße Farbe. B) Chitosan/PEO-Nanofaservlies mit eingearbeitetem Genipin nach dem Waschvorgang, blau-grüne Verfärbung und leichte Verformung der Membran aufgrund der bei der Reaktion mit Genipin gebildeten Chitosanderivate.
Außerdem zeigen die Proben mit Genipin nach 24 Stunden in PBS und anschließender Trocknung eine Zunahme des Gewichts und des Faserdurchmessers, wie in Abbildung 5 dargestellt. Bei ungefilterten Proben beträgt die Gewichtsveränderung +33,9 ± 5,2 % und bei gefilterten Proben +46,2 ± 7,1 %.
Abbildung 5: Links: Faserdurchmesser vor und nach dem Waschvorgang; Rechts: Massenänderung aufgrund der Quellung der Nanofasern
Der Faserdurchmesser im gequollenen Zustand beträgt bei ungefilterten Proben 901 ± 105 nm, was einer Zunahme von 60,9 ± 4,3 % entspricht. Bei gefilterten Proben beträgt der gequollene Durchmesser 705 ± 102 nm, was einer Zunahme von 52,2 ± 0,6 % entspricht.
Literaturliste
[CMH+08] Chen, Zonggang; Mo, Xiumei; He, Chuanglong; Wang, Hongsheng
Intermolecular interactions in electrospun collagen–chitosan complex nanofibers
Carbohydrate Polymers. Bd. 72 (2008) H. 3, S. 410–418
[KC17] Kishan, Alysha P.; Cosgriff-Hernandez, Elizabeth M.
Recent advancements in electrospinning design for tissue engineering applications: A review Journal of biomedical materials research. Part A. Bd. 105 (2017) H. 10, S. 2892–2905
[MFS+14] Mirzaei, Esmaeil; Faridi-Majidi, Reza; Shokrgozar, Mohammad Ali; Asghari Paskiabi, Farnoush
Genipin cross-linked electrospun chitosan-based nanofibrous mat as tissue engineering scaffold Nanomedicine Journal. Bd. 1 (2014) H. 3, S. 137–146
[MSS00] Mi, Fwu-Long; Sung, Hsing-Wen; Shyu, Shin-Shing
Synthesis and characterization of a novel chitosan-based network prepared using naturally occurring crosslinker Journal of Polymer Science Part A: Polymer Chemistry. Bd. 38 (2000) H. 15, S. 2804–2814
[RVM+11] Rakkapao, Natthida; Vao-soongnern, Visit; Masubuchi, Yuichi; Watanabe, Hiroshi
Miscibility of chitosan/poly(ethylene oxide) blends and effect of doping alkali and alkali earth metal ions on chitosan/PEO interaction
Polymer. Bd. 52 (2011) H. 12, S. 2618–2627
[SHH+99] Sung, H. W.; Huang, R. N.; Huang, L. L.; Tsai, C. C.
In vitro evaluation of cytotoxicity of a naturally occurring cross-linking reagent for biological tissue fixation
Journal of biomaterials science. Polymer edition. Bd. 10 (1999) H. 1, S. 63–78
Kontakt: thomas.schneiders@ita.rwth-aachen.de
ITA Institut für Textiltechnik der RWTH Aachen University, Otto-Blumenthal-Straße 1, 52074 Aachen
More entries from ITA Institut für Textiltechnik der RWTH Aachen University